
40℃!最近,很多人感染新冠病毒,体温会飙升到40℃,令人感到害怕。该如何处理呢?另外,为什么体温上升,我们却感觉身上忽冷忽热呢?这又是何缘故?脑袋昏昏沉沉的,一阵一阵的晕眩感向我袭来,脸红红的,手心也是热的,我想靠近窗,挣扎着坐起来,将手和脸贴紧玻璃,让它们吸走我的热气,刚靠近,却又觉得寒气逼人,马上缩回被子里,裹紧。一觉从下午睡到了晚上,似乎好受了一些,全身酸痛无力,还是难受,吸进去的空气像刀一样刮着干燥的喉咙。好不容易爬起来测了下体温和新冠抗原,体温38.6℃,抗原两条杠。这就是我的新冠经历。随着奥密克戎毒株的迅速扩散,身边(新冠)阳性的朋友越来越多,症状各异,有头疼、全身酸、刀片嗓、水泥鼻等,但几乎无一例外,都伴随着发高烧,却又感到“忽冷忽热”。高烧平躺的同时,我的专业劲也来了。为啥感冒、新冠病毒等病毒感染都会引起发烧呢?发烧之后,为什么我还会觉得冷?发烧需要立刻吃药吗?躺在床上的我不禁开始琢磨这些问题。影响我们对于体温感知的一个机制,是体温的设定系统。对于人类等恒温动物来说,调节机体产热和散热过程使体温在复杂多变的地球环境中保持相对稳定,对动物生存、生活具有重要意义。首先,人类机体各个部位都存在感受温度变化的温度感受器,分为外周温度感受器和中枢温度感受器。外周温度感受器广泛分布于全身皮肤、粘膜、内脏和肌肉等处,都是能感受冷、热刺激的游离神经末梢;中枢温度感受器是指分布在脊髓、延髓、脑干网状结构以及下丘脑等处与体温调节相关的温度敏感神经元。外周温度感受器和中枢温度感受器分别能感受到外界环境和中枢神经系统的温度信息,以及机体受到感染时产生的具有致热效应的炎性细胞因子和致热介质[1,2]。然后,当这些来自外周和中枢的温度信号和免疫信号传入到体温调节中枢后,中枢会对这些信息进行整合后发出指令信号,经传出神经或神经内分泌途径下传引起骨骼肌、内分泌腺、皮肤血管等活动的变化,改变机体的产热和散热能力,使体温维持于相对稳定状态[3]。体温调节中枢对于我们维持体温的平衡有重要作用,但是,体温调节中枢到底在哪儿呢?温度信息在哪儿整合呢?20世纪初,Isaac Ott、Isenschmid等人已经通过兔子身上的实验发现,下丘脑在体温调节中发挥了主要作用[2,3]。后续一系列实验研究还证明,下丘脑视前区(POA)是机体最重要的体温调节中枢之一[3-5]。例如,笔者实验室2017年发表在《美国科学院院报》(PNAS)上的文章发现:在小鼠中,热(38摄氏度)会激活下丘脑视前区的神经元。利用光遗传学手段激活这些神经元,则会触发强烈的体温下降和活动度降低;而抑制这些神经元则会迅速升高体温,达到高烧水平(40.7摄氏度)[6]。为了进一步阐明正常体温维持相对恒定的原理,科学家提出理论模型:下丘脑视前区存在一个与恒温箱温度调节器类似的调定点(set-point)。正常生理状态下,体温调定点在36-37℃之间。虽然目前对于体温调定的机制仍然了解不足,但实验证明,视前区的热敏神经元可能参与体温的调定。当视前区的温度超过调定点时,视前区发出散热增加和产热降低的指令,反之则产热与散热平衡向反方向移动。笔者所在的实验室近期还发现:视前区一群特异性热敏神经元(TRPC4+),可以感知大脑的温度,影响体温调定,在高温下体温维持和限制发烧中发挥重要作用[7]。
这和上文提到的体温调定点密切相关。已有的研究观察到,当人体被新冠病毒或其它致病的细菌、病毒感染后,下丘脑的体温调定点会升高。当我们受到病毒或细菌的感染时,身体免疫系统激活,免疫系统中的巨噬细胞分泌产生具有致热效应的炎性细胞因子,如IL-1等,这些炎性细胞因子能激活更多的免疫细胞,从而发挥杀菌作用。但是在激活免疫细胞的同时,IL-1等炎性细胞因子还会通过细胞膜特异性受体,与POA脑区的神经星形胶质细胞发生联系,启动环氧合酶2(COX2)的表达,COX2紧接着促进前列腺素E2(PGE2)的表达。而PGE2能够与POA脑区神经元上的特异性受体EP3结合,抑制POA脑区的神经元活性,提高体温调定点,具有强烈的生热作用。于是,在经历了如同多米诺骨牌一般的连锁反应后,我们的体温开始剧烈上升,即发烧,如图1[8,9]。图1:发烧的分子机制。细菌、病毒等病原体感染,巨噬细胞分泌IL-1,启动COX2表达,促进PGE2产生增加,PGE2与下丘脑视前区神经元上特异性受体EP3结合,抑制下丘脑视前区神经元的活性,引起发烧。图改自[8,9]大量研究证明,在外周或中枢注射前列腺素,特别是其中的前列腺素E2(PGE2),具有强烈的诱导发烧作用。而IL-1也是前列腺素(PG)合成限速酶——环氧化酶(COX2)的合成刺激因子。当病毒或细菌感染后,被体内的免疫细胞识别,启动免疫反应,IL-1分泌会增加20到100倍,促进PGE2生成表达。只有当外源感染的细菌或病毒被免疫系统消杀殆尽时,发烧才能消退[10,11]。而现在最广泛应用的药物退烧原理,均是是抑制环氧化酶COX2的活性,抑制前列腺素E2的合成,阻断了体温调定点的上升,使体温调定点恢复到正常水平。但是,为什么体温上升,我们却会感觉身上忽冷忽热呢?当人体受到新冠病毒或其它致病菌感染后,下丘脑POA脑区神经元活性被抑制,体温调定点升高。此时,人体体温低于下丘脑体温调定点,中枢内部的冷觉温度感受器兴奋,将冷觉信息传递到大脑,我们便会感觉到寒冷、发冷[12]。然后,下丘脑立即调控下游组织和器官,血管收缩,骨骼肌战栗等减少散热,增加产热。使体温达到下丘脑新的体温调定点。故体温能长时间维持在37℃以上。但是当长时间发烧时,高温会对身体其它组织和器官造成严重损伤,这些组织和器官又将高热信息传递给大脑,此时我们便又会感觉到热。总结起来,在病毒感染初期,我们一般会感觉到寒冷、畏冷,预示着我们即将发烧,而长时间发烧后,身体其它组织和器官不堪重负,将高热信息传递到中枢,我们便又会感觉到热。这便是我们发烧会感到“忽冷忽热”的生理学原理。针对发烧产生的分子机制和体温维持原理,主要采取药物降温和物理降温的退烧措施[13]。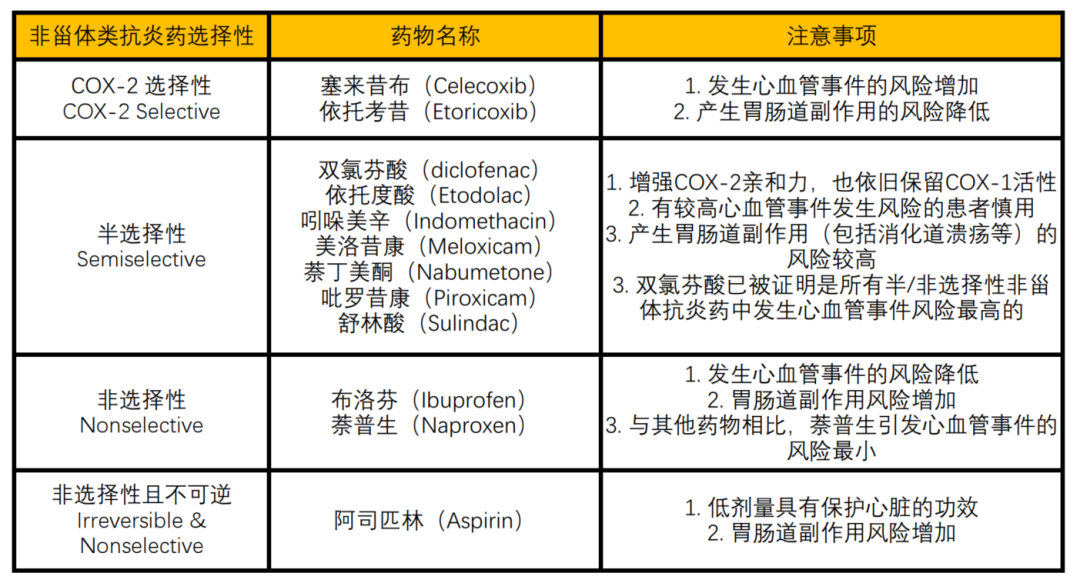 图2:市面上常用的非甾体类抗炎药及其分类、用药注意事项今天主要介绍一下市面上最常见、也是目前大家首选的两种应对新冠的退烧止痛药:布洛芬[14,15]和对乙酰氨基酚[16,17]。布洛芬,又名异丁苯丙酸,以商品名“芬必得”为大众所熟知。布洛芬集止痛、退烧、消炎功能于一身,是目前市场上使用最为广泛的非甾体类抗炎药(NSAIDs)。布洛芬由丙酸衍生得到,最初作为阿司匹林的安全替代品而被研发出来,是历史上第一款非处方(OTC)的非甾体类抗炎药(NSAIDs)。作为非选择性COX抑制剂,其能有效抑制中枢系统中COX-1和COX-2的活性,减少前列腺素的合成,从而达到抑制疼痛、发热和急性炎症的目的。需要注意的是,布洛芬对COX-1的抑制也会带来包括消化道溃疡在内的一系列副作用。而另一种常用退烧药对乙酰氨基酚,常常并不以其本名示人。对乙酰氨基酚俗称扑热息痛,或以泰诺等商品名为大家所熟知。对乙酰氨基酚是一类广泛使用的解热镇痛药物,既可以单独成药,也常与其他药物联合,出现在超过六百种非处方(OTC)过敏药物、感冒药、安眠药和止痛药中。对乙酰氨基酚直接作用于大脑的中枢神经系统,通过抑制体温调节中枢内COX-2的活性,从而抑制前列腺素的合成与释放,达到下调下丘脑体温调定点、促进身体散热并降低体温的目的。前列腺素也是引起疼痛感觉的主要原因,因此对乙酰氨基酚在降低体温的同时也可以起到抑制身体疼痛的效果。 可见,布洛芬对中枢COX酶的广谱抑制效果更加广泛,而对乙酰氨基酚则更注重抑制参与发烧过程的COX-2。不同的机制带来不同的效果——布洛芬的镇痛效果要略胜对乙酰氨基酚一筹,而在退烧效果上,则是对乙酰氨基酚拔得头筹。图3:止痛神药布洛芬(左)与退烧首选对乙酰氨基酚(右)的结构式虽然在一定程度上,加大药物剂量能起到更快更强的退烧镇痛效果,但近期诸多因过度服用对乙酰氨基酚导致肝损伤疾病的新闻报道,向我们敲响了警钟。事实上,对乙酰氨基酚并不属于布洛芬所处的“非甾体类抗炎药”的范畴,不具有外周抗炎的作用,同时其在患者体内起效的过程中,会产生毒性较大的氧自由基和自由基代谢产物NAPQI(N-乙酰-对苯醌亚胺),而肝脏作为对乙酰氨基酚主要的代谢部位,则成为了这类毒性物质的主要攻击目标。我们知道肝脏是机体内最强大、最重要的解毒器官,然而再强大的器官也有其能力上限。如果过度服用对乙酰氨基酚时,上述氧自由基的形成便会远超肝细胞的解毒功能,致使肝细胞损伤甚至死亡,从而诱发急性肝衰竭[18]。正如前文所提,对乙酰氨基酚是各类西式感冒药的组分常客。因此,当我们因各种原因选择将几种感冒药混吃的时候,切记检查其中是否都含有对乙酰氨基酚成分,因为稍有不慎,过量摄入的对乙酰氨基酚就会从新冠病毒的抵抗者变为肝脏的无情杀手。新冠固然可怕,但我们在服药时也需时刻牢记“是药三分毒”的道理,尤其是药物本身的剂量效应,以及多种药物联用时可能出现的副作用,都是会令患者倒在战胜新冠的胜利前夜的潜在危险。在缺少翔实的药物服用知识基础时,仔细阅读药物说明书、咨询医师、网络问诊等都将是确保用药安全的有效途径。在布洛芬和对乙酰氨基酚热销乃至时常脱销的当下,很多类似的消炎镇痛药物也受到患者的关注。吲哚美辛、双氯芬酸等非甾体类抗炎药均具有很强的抗炎、镇痛和退烧效果,但正如布洛芬和对乙酰氨基酚之间的差异一样,不同药物针对抗炎镇痛或退烧降温的侧重点有所不同,同时其也会带来各种各样的副作用。因此在选择用药时,一定要结合自己当下的疾病发展状态(例如以退烧为先还是止痛为先)和既往病史(是否有心血管问题、是否胃肠道较为脆弱等),综合判断,以达到最好的治疗效果。
图2:市面上常用的非甾体类抗炎药及其分类、用药注意事项今天主要介绍一下市面上最常见、也是目前大家首选的两种应对新冠的退烧止痛药:布洛芬[14,15]和对乙酰氨基酚[16,17]。布洛芬,又名异丁苯丙酸,以商品名“芬必得”为大众所熟知。布洛芬集止痛、退烧、消炎功能于一身,是目前市场上使用最为广泛的非甾体类抗炎药(NSAIDs)。布洛芬由丙酸衍生得到,最初作为阿司匹林的安全替代品而被研发出来,是历史上第一款非处方(OTC)的非甾体类抗炎药(NSAIDs)。作为非选择性COX抑制剂,其能有效抑制中枢系统中COX-1和COX-2的活性,减少前列腺素的合成,从而达到抑制疼痛、发热和急性炎症的目的。需要注意的是,布洛芬对COX-1的抑制也会带来包括消化道溃疡在内的一系列副作用。而另一种常用退烧药对乙酰氨基酚,常常并不以其本名示人。对乙酰氨基酚俗称扑热息痛,或以泰诺等商品名为大家所熟知。对乙酰氨基酚是一类广泛使用的解热镇痛药物,既可以单独成药,也常与其他药物联合,出现在超过六百种非处方(OTC)过敏药物、感冒药、安眠药和止痛药中。对乙酰氨基酚直接作用于大脑的中枢神经系统,通过抑制体温调节中枢内COX-2的活性,从而抑制前列腺素的合成与释放,达到下调下丘脑体温调定点、促进身体散热并降低体温的目的。前列腺素也是引起疼痛感觉的主要原因,因此对乙酰氨基酚在降低体温的同时也可以起到抑制身体疼痛的效果。 可见,布洛芬对中枢COX酶的广谱抑制效果更加广泛,而对乙酰氨基酚则更注重抑制参与发烧过程的COX-2。不同的机制带来不同的效果——布洛芬的镇痛效果要略胜对乙酰氨基酚一筹,而在退烧效果上,则是对乙酰氨基酚拔得头筹。图3:止痛神药布洛芬(左)与退烧首选对乙酰氨基酚(右)的结构式虽然在一定程度上,加大药物剂量能起到更快更强的退烧镇痛效果,但近期诸多因过度服用对乙酰氨基酚导致肝损伤疾病的新闻报道,向我们敲响了警钟。事实上,对乙酰氨基酚并不属于布洛芬所处的“非甾体类抗炎药”的范畴,不具有外周抗炎的作用,同时其在患者体内起效的过程中,会产生毒性较大的氧自由基和自由基代谢产物NAPQI(N-乙酰-对苯醌亚胺),而肝脏作为对乙酰氨基酚主要的代谢部位,则成为了这类毒性物质的主要攻击目标。我们知道肝脏是机体内最强大、最重要的解毒器官,然而再强大的器官也有其能力上限。如果过度服用对乙酰氨基酚时,上述氧自由基的形成便会远超肝细胞的解毒功能,致使肝细胞损伤甚至死亡,从而诱发急性肝衰竭[18]。正如前文所提,对乙酰氨基酚是各类西式感冒药的组分常客。因此,当我们因各种原因选择将几种感冒药混吃的时候,切记检查其中是否都含有对乙酰氨基酚成分,因为稍有不慎,过量摄入的对乙酰氨基酚就会从新冠病毒的抵抗者变为肝脏的无情杀手。新冠固然可怕,但我们在服药时也需时刻牢记“是药三分毒”的道理,尤其是药物本身的剂量效应,以及多种药物联用时可能出现的副作用,都是会令患者倒在战胜新冠的胜利前夜的潜在危险。在缺少翔实的药物服用知识基础时,仔细阅读药物说明书、咨询医师、网络问诊等都将是确保用药安全的有效途径。在布洛芬和对乙酰氨基酚热销乃至时常脱销的当下,很多类似的消炎镇痛药物也受到患者的关注。吲哚美辛、双氯芬酸等非甾体类抗炎药均具有很强的抗炎、镇痛和退烧效果,但正如布洛芬和对乙酰氨基酚之间的差异一样,不同药物针对抗炎镇痛或退烧降温的侧重点有所不同,同时其也会带来各种各样的副作用。因此在选择用药时,一定要结合自己当下的疾病发展状态(例如以退烧为先还是止痛为先)和既往病史(是否有心血管问题、是否胃肠道较为脆弱等),综合判断,以达到最好的治疗效果。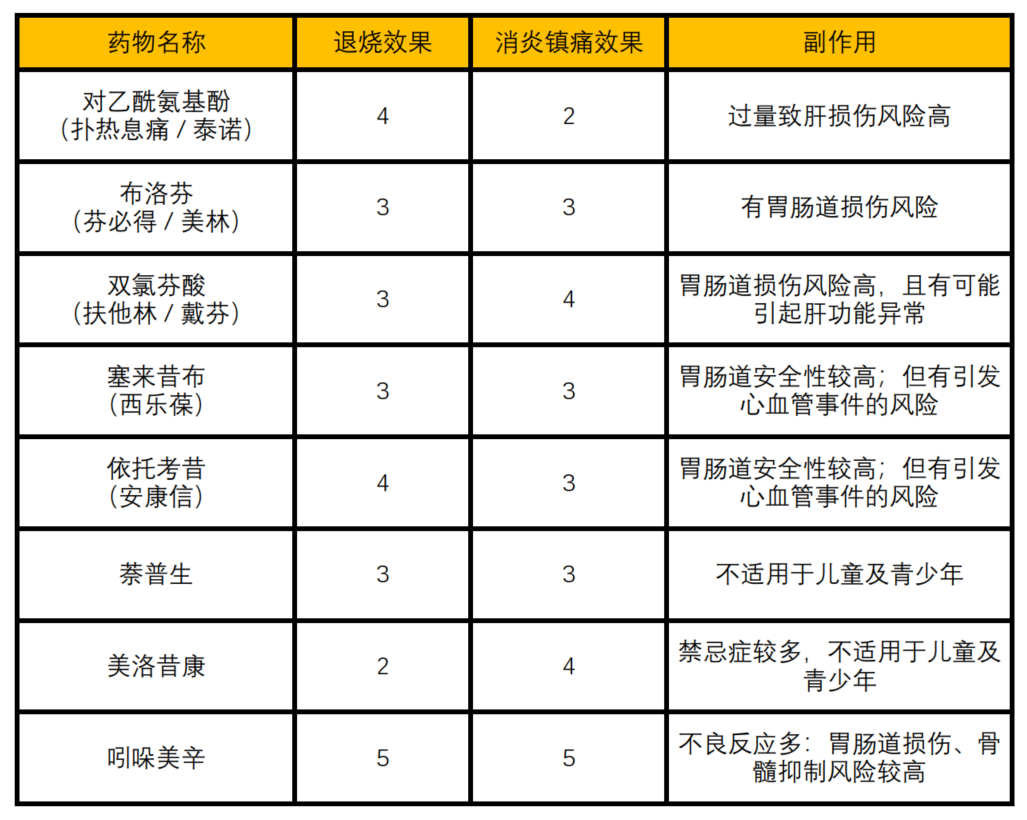 图4:部分消炎止痛退烧药的效果评价(仅供参考)另外,由于降温药物的时间和剂量限制,我们也可以采取各种物理降温措施辅助治疗,给新冠病毒一个“内外夹攻”。人体体表散热主要依赖皮肤表面的汗液蒸发与呼气时的水分蒸发(在不考虑对流、传导和辐射散热的情况下),因此,在全身上下,尤其是腋窝、肘窝、手心、腹股沟、腘窝等大血管丰富处用34℃左右的温水进行擦拭,可以通过水分的蒸发带走体表的大量热量,加快机体散热进程。此外,也可以用湿毛巾,冰袋冷敷额头等方式进行物理降温,避免长期高热对大脑的影响。“发烧不是一种疾病,而是身体对疾病的反应。” 德国内科医生,临床测温学先驱卡尔·温德里希曾如此描述发烧。越来越多的证据表明,发热期间核心体温上升1-4℃,可以帮助人类显著提高在许多感染类疾病中的生存率。有文献研究报道,在感染流感病毒的危重症人群中使用退烧药,增加了患病人群5%的死亡率,且对病人预后产生负面影响。同时,对感染牛瘟病毒的兔子中进行研究也发现,使用乙酰水杨酸抑制兔子发烧时,70%的兔子死于感染,而发烧反应正常的兔子中,只有16%死于感染[19]。发烧的第一重功效是抑制病毒或细菌的复制,降低其感染能力。在哺乳动物细胞中,升高温度(1-4℃)能降低骨髓灰质炎病毒的复制效率200倍以上,同时能增加革兰氏阴性细菌对血清的敏感性,加速细菌裂解。发烧的第二重好处是强化感染期间的免疫保护机制。发烧时,体温升高,代谢加快,血流速度增加,帮助免疫细胞更快地游走和“gank”;同时体温升高会激活中性粒细胞和巨噬细胞等免疫细胞,吞噬和杀灭各种感染病原体,提高对细菌和病毒的清除率[20]。 虽然发烧对于抵抗外来病原体侵害有一定的促进作用,但长时间的发烧却对身体有害。高体温对细胞具有直接毒性,影响细胞膜稳定性,使DNA和蛋白质合成受阻,甚至直接诱导细胞死亡;高体温也能造成多器官功能衰竭,增加消化道的通透性,降低肾脏对血液的滤过,造成肝功能障碍,脑神经和认知功能障碍等。这是因为热量的堆积会对细胞、组织、器官造成热损伤,可使个体面临短期或长期的功能障碍,如果体温继续上升或持续发烧,严重时可能导致死亡[21]。所以,当身体面临长时间发烧时,应及时采用各种降温措施,正如世界卫生组织所推荐,发烧高于38.5℃时即需要进行降温处理。当我们遇到病毒或细菌感染时,病毒或细菌作为外源感染物,激活人体免疫系统,分泌炎性致热因子,提高下丘脑调控的体温调定点,所以在感染初期,我们常常感觉到寒冷且畏冷,此时下丘脑发出体温调节指令,调节皮肤血管收缩和抑制汗腺活动减少皮肤散热,调节骨骼肌战栗增加产热。减少散热同时增加产热,将体温上升到新的调定点,长时间的发烧,骨骼肌一直在战栗产热,此时便有了四肢肌肉酸痛的感觉。如果长时间体温处于38.5℃以上,可进行药物或者物理降温。
图4:部分消炎止痛退烧药的效果评价(仅供参考)另外,由于降温药物的时间和剂量限制,我们也可以采取各种物理降温措施辅助治疗,给新冠病毒一个“内外夹攻”。人体体表散热主要依赖皮肤表面的汗液蒸发与呼气时的水分蒸发(在不考虑对流、传导和辐射散热的情况下),因此,在全身上下,尤其是腋窝、肘窝、手心、腹股沟、腘窝等大血管丰富处用34℃左右的温水进行擦拭,可以通过水分的蒸发带走体表的大量热量,加快机体散热进程。此外,也可以用湿毛巾,冰袋冷敷额头等方式进行物理降温,避免长期高热对大脑的影响。“发烧不是一种疾病,而是身体对疾病的反应。” 德国内科医生,临床测温学先驱卡尔·温德里希曾如此描述发烧。越来越多的证据表明,发热期间核心体温上升1-4℃,可以帮助人类显著提高在许多感染类疾病中的生存率。有文献研究报道,在感染流感病毒的危重症人群中使用退烧药,增加了患病人群5%的死亡率,且对病人预后产生负面影响。同时,对感染牛瘟病毒的兔子中进行研究也发现,使用乙酰水杨酸抑制兔子发烧时,70%的兔子死于感染,而发烧反应正常的兔子中,只有16%死于感染[19]。发烧的第一重功效是抑制病毒或细菌的复制,降低其感染能力。在哺乳动物细胞中,升高温度(1-4℃)能降低骨髓灰质炎病毒的复制效率200倍以上,同时能增加革兰氏阴性细菌对血清的敏感性,加速细菌裂解。发烧的第二重好处是强化感染期间的免疫保护机制。发烧时,体温升高,代谢加快,血流速度增加,帮助免疫细胞更快地游走和“gank”;同时体温升高会激活中性粒细胞和巨噬细胞等免疫细胞,吞噬和杀灭各种感染病原体,提高对细菌和病毒的清除率[20]。 虽然发烧对于抵抗外来病原体侵害有一定的促进作用,但长时间的发烧却对身体有害。高体温对细胞具有直接毒性,影响细胞膜稳定性,使DNA和蛋白质合成受阻,甚至直接诱导细胞死亡;高体温也能造成多器官功能衰竭,增加消化道的通透性,降低肾脏对血液的滤过,造成肝功能障碍,脑神经和认知功能障碍等。这是因为热量的堆积会对细胞、组织、器官造成热损伤,可使个体面临短期或长期的功能障碍,如果体温继续上升或持续发烧,严重时可能导致死亡[21]。所以,当身体面临长时间发烧时,应及时采用各种降温措施,正如世界卫生组织所推荐,发烧高于38.5℃时即需要进行降温处理。当我们遇到病毒或细菌感染时,病毒或细菌作为外源感染物,激活人体免疫系统,分泌炎性致热因子,提高下丘脑调控的体温调定点,所以在感染初期,我们常常感觉到寒冷且畏冷,此时下丘脑发出体温调节指令,调节皮肤血管收缩和抑制汗腺活动减少皮肤散热,调节骨骼肌战栗增加产热。减少散热同时增加产热,将体温上升到新的调定点,长时间的发烧,骨骼肌一直在战栗产热,此时便有了四肢肌肉酸痛的感觉。如果长时间体温处于38.5℃以上,可进行药物或者物理降温。
特别声明:以上用药指南仅供参考,具体使用时请结合实际情况,按照医生指导和说明书用药。
作者简介:
李章杰,上海科技大学博士研究生一年级,导师为沈伟;
张开达,上海科技大学本硕博在读,现为硕士研究生二年级,导师为沈伟。
审阅者简介:
沈伟,上海科技大学生命学院常任副教授,致力于"中枢-外周"互作研究,包括体温调控、代谢调控等内容。
参考文献
[1] 姚泰,闫剑群,等。生理学[M]. 北京:人民卫生出版社,2015:324-332.[2] 杨永录,胡晓松,等。体温与体温调节生理学[M]. 北京:人民军医出版社,2015:73-103.[3] Morrison SF, Nakamura K. Central Mechanisms for Thermoregulation. Annu Rev Physiol. 2019;81:285-308. doi:10.1146/annurev-physiol-020518-114546[4] Tan CL, Knight ZA. Regulation of Body Temperature by the Nervous System. Neuron. 2018;98(1):31-48. doi:10.1016/j.neuron.2018.02.022[5] Nakamura K. Central circuitries for body temperature regulation and fever. Am J Physiol Regul Integr Comp Physiol. 2011;301(5):R1207-R1228. doi:10.1152/ajpregu.00109.2011[6] Zhao ZD, Yang WZ, Gao C, et al. A hypothalamic circuit that controls body temperature [published correction appears in Proc Natl Acad Sci U S A. 2017 Feb 28;114(9):E1755]. Proc Natl Acad Sci U S A. 2017;114(8):2042-2047. doi:10.1073/pnas.1616255114[7] Zhou Q, Fu X, Xu J, et al. Hypothalamic warm-sensitive neurons require TRPC4 channel for detecting internal warmth and regulating body temperature in mice [published online ahead of print, 2022 Nov 29]. Neuron. 2022;S0896-6273(22)01029-7. doi:10.1016/j.neuron.2022.11.008[8] Ichikawa A, Sugimoto Y, Tanaka S. Molecular biology of histidine decarboxylase and prostaglandin receptors. Proc Jpn Acad Ser B Phys Biol Sci. 2010;86(8):848-866. doi:10.2183/pjab.86.848[9] Eberwine J, Bartfai T. Single cell transcriptomics of hypothalamic warm sensitive neurons that control core body temperature and fever response Signaling asymmetry and an extension of chemical neuroanatomy. Pharmacol Ther. 2011;129(3):241-259. doi:10.1016/j.pharmthera.2010.09.010[10] Evans SS, Repasky EA, Fisher DT. Fever and the thermal regulation of immunity: the immune system feels the heat. Nat Rev Immunol. 2015;15(6):335-349. doi:10.1038/nri3843[11] Eccles R. Understanding the symptoms of the common cold and influenza. Lancet Infect Dis. 2005;5(11):718-725. doi:10.1016/S1473-3099(05)70270-X[12] Bartfai T, Conti B. Fever. Scientific World Journal. 2010;10:490-503. Published 2010 Mar 16. doi:10.1100/tsw.2010.50[13] 听谢医生说抗炎镇痛药(NSAIDs):第三篇https://zhuanlan.zhihu.com/p/32715746?utm_source=wechat_session&utm_medium=social&s_r=0[14] https://en.wikipedia.org/wiki/Ibuprofen[15] Drugbank. https://go.drugbank.com/drugs/DB01050[16] https://en.wikipedia.org/wiki/Paracetamol[17] Drugbank. https://go.drugbank.com/drugs/DB00316[18] 王帆,朱哿瑞,刘成海,陶艳艳.对乙酰氨基酚致药物性肝损伤的分子机制[J].肝脏,2021,26(08):939-942.DOI:10.14000/j.cnki.issn.1008-1704.2021.08.030[19] Earn DJ, Andrews PW, Bolker BM. Population-level effects of suppressing fever. Proc Biol Sci. 2014;281(1778):20132570. Published 2014 Jan 22. doi:10.1098/rspb.2013.2570[20] Foxman EF, Storer JA, Vanaja K, Levchenko A, Iwasaki A. Two interferon-independent double-stranded RNA-induced host defense strategies suppress the common cold virus at warm temperature. Proc Natl Acad Sci U S A. 2016;113(30):8496-8501. doi:10.1073/pnas.1601942113[21] Walter EJ, Hanna-Jumma S, Carraretto M, Forni L. The pathophysiological basis and consequences of fever. Crit Care. 2016;20(1):200. Published 2016 Jul 14. doi:10.1186/s13054-016-1375-5saixiansheng@zhishifenzi.com












